
CONVENIA® 80 mg/mL Poudre et solvant pour solution injectable pour chiens et chats
ZOETISPoudre
Composition
Principes actifs et excipients
Principes actifs
| Nom du principe actif | Quantité de principe actif |
|---|---|
| Céfovécine (sous forme de sel de sodium) | 852 mg |
Excipients
| Nom de l'excipient | Quantité de l'excipient |
|---|---|
| parahydroxybenzoate de méthyle | 19.17 mg/mL |
Clinique
Indications d'utilisation par espèce
- Chien
- Chat
Uniquement pour les infections suivantes qui nécessitent un traitement prolongé. Après administration unique, l'activité antimicrobienne de CONVENIA® dure pendant 14 jours.
Chez les chiens :
- traitement des infections de la peau et des tissus mous notamment pyodermites, plaies et abcès associés à Staphylococcus intermedius, Streptococci β-hémolytique, Escherichia coli et/ou Pasteurella multocida.
- traitement des infections de l’appareil urinaire associées à Escherichia coli et/ou à Proteus spp.
- traitement d'appoint à la thérapie parodontale mécanique ou chirurgicale dans le traitement des infections sévères de la gencive et des tissus parodontaux associées à Porphyromonas spp. et Prevotella spp.
Chats :
- traitement des plaies et abcès de la peau et des tissus mous associés à Pasteurella multocida, Fusobacterium spp., Bacteroides spp., Prevotella oralis, Streptococci β-hémolytique et/ou Staphylococcus intermedius.
- traitement des infections de l’appareil urinaire associées à Escherichia coli.
Voie d'administration et posologie
Voie d'administration
- Sous-cutanée
Posologie
- Chien
- Chat
- Infections de la peau et des tissus mous chez les chiens
Une injection unique par voie sous-cutanée, de 8 mg/kg de poids vif (1 ml par 10 kg de poids vif).
Si nécessaire, le traitement peut être renouvelé à 14 jours d’intervalle jusqu’à 3 fois. Conformément aux bonnes pratiques vétérinaires, le traitement des pyodermites doit être prolongé au-delà de la disparition complète des signes cliniques.
- Infections sévères des tissus gingivaux et parodontaux chez les chiens
Une injection unique par voie sous-cutanée, de 8 mg/kg de poids vif (1ml par 10 kg de poids vif).
- Plaies et abcès de la peau et des tissus mous chez les chats
Une injection unique par voie sous-cutanée de 8 mg/kg de poids vif (1 ml par 10 kg de poids vif).
Si nécessaire, une dose supplémentaire peut être administrée 14 jours après la première injection.
- Infections de l’appareil urinaire chez les chiens et les chats
Une injection unique par voie sous-cutanée de 8 mg/kg de poids vif (1 ml par 10 kg de poids vif).
Pour reconstituer, prélever 10 ml du diluant et l’ajouter dans le flacon contenant la poudre lyophilisée.
Agiter le flacon jusqu’à ce que la poudre soit complètement dissoute.
Tableau posologique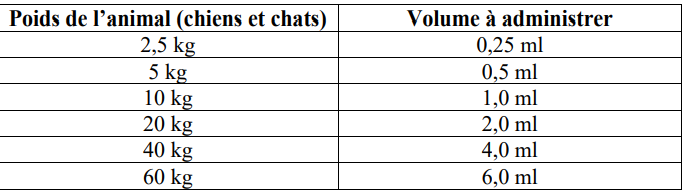
Pour s’assurer d’un dosage correct, le poids de l’animal doit être déterminé aussi précisément que possible afin d'éviter un sous-dosage.
Temps d'attente
- Chien
- Chat
Denrée Durée Unité Voie(s) d'administration Sans objet 0 Sans objet
Complément d'information temps d'attente
Toutes cibles :
Sans objet.
Contre indications
Ne pas utiliser en cas d’hypersensibilité aux céphalosporines ou aux pénicillines.
Ne pas utiliser chez les petits herbivores (notamment cochons d’Inde et lapins).
Ne pas utiliser chez les chiens et les chats de moins de 8 semaines d’âge.
Mises en garde particulières à chaque espèce cible
Toutes cibles :
Aucune.
Précautions particulières d'emploi
Précautions particulières pour une utilisation sûre chez les espèces cibles
Il est recommandé de réserver les céphalosporines de troisième génération au traitement de situations cliniques qui ont répondu faiblement ou sont susceptibles de répondre faiblement aux autres classes d’antibiotiques ou aux céphalosporines de première génération. L’utilisation du produit doit être basée sur la réalisation d'antibiogrammes et doit prendre en compte les directives politiques officielles et locales d’utilisation des antibiotiques. Une intervention mécanique et/ou chirurgicale par le vétérinaire est indispensable au traitement de maladies parodontales. La sécurité d’emploi de Convenia n’a pas été évaluée chez les animaux souffrant d’insuffisance rénale sévère. Une pyodermite est souvent secondaire à une pathologie sous-jacente. Il est donc conseillé d’identifier la cause sous-jacente et de traiter l’animal en conséquence. Une attention particulière doit être portée aux patients qui ont déjà présenté des réactions d’hypersensibilité à la céfovécine, à d’autres céphalosporines, pénicillines, ou d’autres médicaments. Si une réaction allergique se produit, aucune autre administration de céfovécine ne doit être réalisée et un traitement approprié pour les allergies aux bêtalactamines doit être instauré. Certaines réactions graves d’hypersensibilité aiguë peuvent nécessiter un traitement avec de l’épinéphrine et d’autres mesures d’urgence, notamment de l’oxygène, une fluidothérapie intraveineuse, une administration d’antihistaminique par voie intraveineuse, des corticostéroïdes et une surveillance des voies respiratoires, selon le tableau clinique. Les vétérinaires doivent être informés que les symptômes allergiques peuvent réapparaître quand le traitement symptomatique est interrompu. Occasionnellement, les céphalosporines ont été associées à une myélotoxicité, provoquant une neutropénie toxique. D’autres réactions hématologiques observées avec les céphalosporines comprennent une neutropénie, une anémie, une hypoprothrombinémie, une thrombocytopénie, un 4 allongement du temps de prothrombine (TP) ou du temps de céphaline activée (TCA), une altération de la fonction plaquettaire.
Précautions particulières à prendre par la personne qui administre le médicament
Les pénicillines et les céphalosporines peuvent provoquer une hypersensibilité (allergie) à la suite de leur injection, inhalation, ingestion ou au contact de la peau. L’hypersensibilité aux pénicillines peut conduire à des réactions croisées avec les céphalosporines et réciproquement. Les réactions allergiques à ces substances peuvent parfois être graves. Ne pas manipuler le produit en cas d’hypersensibilité connue ou s’il vous a été recommandé de ne pas travailler avec de telles préparations. Manipulez le produit avec soin en prenant les précautions conseillées pour éviter toute exposition. Si, à la suite d’une exposition, vous développez des symptômes comme un érythème cutané, consultez un médecin. Un œdème du visage, des lèvres, des yeux ou une difficulté respiratoire, sont des symptômes plus graves qui nécessitent une consultation médicale d’urgence. Si vous êtes allergique aux pénicillines ou aux céphalosporines, éviter tout contact avec les litières contaminées. En cas de contact, laver la peau avec de l’eau et du savon.
Précautions particulières concernant la protection de l'environnement
Aucune
Autres précautions
Aucune
Interactions médicamenteuses et autres formes d'interaction
L’utilisation concomittante d’autres substances ayant une très forte liaison aux protéines (par ex : furosémide, kétoconazole ou anti-inflammatoires non stéroïdiens (AINS)) peut interférer avec la liaison de la céfovécine et donc provoquer des effets indésirables.
Utilisation en cas de gravidité de lactation ou de ponte
La sécurité d’emploi de Convenia n’a pas été démontrée chez les chiennes et les chattes gestantes et allaitantes. Les animaux traités ne doivent pas être mis à la reproduction dans les 12 semaines suivant la dernière administration.
Effets indésirables
Des effets gastro-intestinaux incluant vomissements, diarrhées et/ou anorexie ont été observés dans de très rares cas. Des signes neurologiques (ataxie, convulsions ou crise épileptique) et des réactions au site d’injection ont été rapportés dans de très rares cas après l’utilisation du produit. Des réactions d’hypersensibilité (par ex. anaphylaxie, dyspnée, choc circulatoire) peuvent survenir très rarement. Si une telle réaction se produit, un traitement approprié doit être administré sans tarder (voir également la rubrique 4.5 « Précautions particulières d’emploi chez l’animal »). La fréquence des effets indésirables est définie comme suit : - très fréquent (effets indésirables chez plus d’1 animal sur 10 animaux traités) - fréquent (entre 1 et 10 animaux sur 100 animaux traités) - peu fréquent (entre 1 et 10 animaux sur 1 000 animaux traités) - rare (entre 1 et 10 animaux sur 10 000 animaux traités) - très rare (moins d’un animal sur 10 000 animaux traités, y compris les cas isolés).
Surdosage (symptômes, conduite d’urgences, antidotes)
L’administration répétée (8 administrations) à 14 jours d’intervalle de cinq fois la dose recommandée a été bien tolérée chez les jeunes chiens. De légers gonflements transitoires ont été observés au site d’injection après la 1ère et la 2e administration.
L’administration unique d’une dose 22,5 fois supérieure à la dose recommandée a provoqué un œdème transitoire et une gêne au site d’injection.
L’administration répétée (8 administrations) à 14 jours d’intervalle de cinq fois la dose recommandée a été bien tolérée chez les jeunes chats.
L’administration unique d’une dose 22,5 fois supérieure à la dose recommandée a provoqué un œdème transitoire et une gêne au site d’injection.
Informations pharmacologiques ou immunologiques
codes ATC
QJ01DD91 : céfovécine
Pharmacodynamie
Groupe pharmacothérapeutique : Antibactériens à usage systémique (céphalosporines)
La céfovécine est une céphalosporine de 3e génération qui a un large spectre d’activité contre les bactéries Gram - et Gram +.
Elle se différencie de nombreuses autres céphalosporines par sa forte liaison aux protéines et sa longue durée d’action. Comme avec toutes les céphalosporines, l’action de la céfovécine résulte de l’inhibition de la synthèse de la paroi bactérienne ; la céfovecine a une activité bactéricide.
La céfovécine a une activité in vitro contre Staphylococcus intermedius et Pasteurella multocida qui sont associées aux infections de la peau chez les chiens et les chats. Il a aussi été prouvé que les bactéries anaérobies comme Bacteroides spp. et Fusobacterium spp. isolées dans les abcès félins sont sensibles à la céfovécine. Il a aussi été montré que Porphyromonas gingivalis et Prevotella intermedia isolées de maladies parodontales chez le chien sont sensibles à la céfovécine. De plus, la céfovécine a une activité in vitro contre Escherichia coli qui est associé aux infections de l’appareil urinaire chez les chiens et les chats.
L’activité in vitro contre ces bactéries ainsi que contre d’autres pathogènes de la peau et de l’appareil urinaire isolés au cours d’une étude Européenne (1999-2000) des CMI (Danemark, France, Allemagne, Italie et Royaume Uni) et pendant les études cliniques d’efficacité et de sécurité (2001- 2003) Européenne (France, Allemagne, Espagne et Royaume Uni) est détaillée ci-dessous. Les isolats parodontaux ont été collectés pendant une étude clinique d'efficacité et de sécurité (2008- France et Belgique) :
| Bactéries | Origine | Nb d’isolats | ||||
|---|---|---|---|---|---|---|
| Min | Max | CMI50 1 | CMI90 2 | |||
| Staphylococcus Intermedius | Chien | 226 | ≤ 0,06 | 8 | 0,12 | 0,25 |
| Chat | 44 | ≤ 0,06 | 8 | 0,12 | 0,25 | |
| β haemolitic Streptococcus spp. | Chien | 52 | ≤ 0,06 | 16 | ≤ 0,06 | 0,12 |
| Chat | 34 | ≤ 0,06 | 1 | ≤ 0,06 | 0,12 | |
| Staphylococcus spp. coagulase négative2 | Chat | 16 | 0,12 | 32 | 0,25 | 8 |
| Staphylococcus aureus3,4 | Chien4 | 16 | 0,5 | 1 | 1 | 1 |
| Chat4 | 20 | 0,5 | >32 | 1 | 16 | |
| Staphylococcus spp. coagulase positivé3,4 | Chien4 | 24 | 0,12 | > 32 | 0,25 | 0,5 |
| Chat4 | ||||||
| Escherichia coli | Chien | 167 | 0,12 | > 32 | 0,5 | 1 |
| Chat | 93 | 0,25 | 8 | 0,5 | 1 | |
| Pasteurella multocida | Chien | 47 | ≤ 0,06 | 0,12 | ≤ 0,06 | 0,12 |
| Chat | 146 | ≤ 0,06 | 2 | ≤ 0,06 | 0,12 | |
| Proteus spp.4 | Chien | 52 | 0,12 | 8 | 0,25 | 0,5 |
| Chat4 | 19 | 0,12 | 0,25 | 0,12 | 0,25 | |
| Enterobacter spp4 | Chien4 | 29 | 0,12 | > 32 | 1 | > 32 |
| Chat4 | 10 | 0,25 | 8 | 2 | 4 | |
| Klebsiella spp4 | Chien4 | 11 | 0,25 | 1 | 0,5 | 1 |
| Chat4 | ||||||
| Prevotella spp. | Chien4 | 25 | ≤ 0,06 | 8 | 0,25 | 2 |
| Chat | 50 | ≤ 0,06 | 4 | 0,25 | ||
| Fusobacterium spp. | Chat | 23 | ≤ 0,06 | 2 | 0,12 | 1 |
| Bacteroides spp. | Chat | 24 | ≤ 0,06 | 8 | 0,25 | 4 |
1La plus petite concentration, qui inhibe entièrement la croissance visible d’au moins 50 % des isolats
2La plus petite concentration, qui inhibe entièrement la croissance visible d’au moins 90 % des isolats
3Certains de ces pathogènes (e.g. S. aureus) ont montré in vitro une résistance naturelle à la céfovécine
4La signification clinique de ces données in vitro n’a pas été démontrée.
La résistance aux céphalosporines résulte d’une inactivation enzymatique (production de β-lactamase), d'une diminution de la perméabilité par mutations des porines ou modification de l'efflux, ou d'une sélection de protéines de faibles affinités pour la pénicilline. La résistance peut être chromosomique ou plasmidique et être transmise si elle est associée à des transposons ou à des plasmides. Une résistance croisée avec d’autres céphalosporines et d’autres β-lactamines peut être observée.
En appliquant la concentration critique microbiologique proposée de S ≤ 2 μg/mL, aucune résistance à la céfovécine n’a été détectée pour les isolats terrains de Pasteurella multocida et Fusobacterium spp.et Porphyromonas spp.
En appliquant la concentration critique microbiologique proposée de I ≤ 4 μg/mL, la résistance à la céfovécine chez les isolats de S. intermedius et Streptococci β-hémolitique est inférieure à 0,02 % et inférieure à 3,4 % chez les isolats de Prevotella intermedia.
Le pourcentage d’isolats résistants d’E. coli, Prevotella oralis, Bacteroides spp. et Proteus spp. ont été respectivement de 2,3 %, 2,7 %, 3,1 % et 1,4 %.
Le pourcentage d’isolats de Staphylococci spp. coagulase négative (par ex: S. xylosus, S. schleiferi, S. epidermidis) résistants à la céfovécine est de 9,5 %.
Les isolats de Pseudomonas spp., Enterococcus spp., et Bordetella bronchiseptica sont intrinsèquement résistants à la céfovécine.
Pharmacocinétique et environnement
La céfovécine a des propriétés pharmacocinétiques uniques avec une demi-vie d’élimination extrêmement longue chez les chiens et les chats.
Chez les chiens
Après administration de la céfovécine en injection unique par voie sous-cutanée à la dose de 8 mg/kg de poids vif, l’absorption est rapide et importante ; la concentration plasmatique maximale 6 heures après l’administration est de 120 μg/mL et la biodisponibilité est approximativement de 99 %. Des pics de concentrations de 31,9 μg/mL ont été mesurés dans le fluide de la cage tissulaire 2 jours après l’administration. Quatorze jours après l’administration, la concentration plasmatique moyenne de céfovécine est de 5,6 μg/mL.
La liaison aux protéines plasmatiques est forte (96,0 % à 98,7 %) et le volume de distribution est faible (0,1 L/kg). La demi-vie d’élimination est d’environ 5,5 jours.
La céfovécine est principalement éliminée sous forme inchangée par voie rénale. Quatorze jours après administration, la concentration dans les urines est de 2,9 μg/mL.
Chez les chats
Après administration de la céfovécine en injection unique par voie sous-cutanée à la dose de 8 mg/kg de poids vif, l’absorption est rapide et importante ; la concentration plasmatique maximale 2 heures après l’administration est de 141 μg/mL et la biodisponibilité est approximativement de 99 %. Quatorze jours après l’administration, la concentration plasmatique moyenne de céfovécine est de 18 μg/mL.
La liaison aux protéines plasmatiques est forte (plus de 99 %) et le volume de distribution est faible (0,09 L/kg). La demi-vie d’élimination est longue - environ 6,9 jours.
La céfovécine est principalement éliminée sous forme inchangée par voie rénale. Dix et quatorze jours après administration la concentration dans les urines est respectivement de 1,3 μg/mL et 0,7 μg/mL. Après des administrations répétées à la dose recommandée, des concentrations plasmatiques élévées de céfovécine ont été observées.
Données pharmaceutiques
Incompatibilités majeures
En l’absence d'études de compatibilité, ce médicament vétérinaire ne doit pas être mélangé avec d'autres médicaments vétérinaires.
Durée de conservation
Durée de conservation du médicament vétérinaire tel que conditionné pour la vente : 3 ans. Durée de conservation après reconstitution conforme aux instructions : 28 jours. Comme avec les autres céphalosporines, la couleur de la solution reconstituée peut brunir pendant cette période. Cependant, si le produit est conservé selon les recommandations, son efficacité n’est pas altérée.
Température de conservation
Avant reconstitution :
À conserver au réfrigérateur (entre +2°C et +8°C). Ne pas congeler.
À conserver dans l’emballage extérieur d'origine de façon à protéger de la lumière.
Après reconstitution :
À conserver au réfrigérateur (entre +2°C et +8°C). Ne pas congeler.
À conserver dans l’emballage extérieur d'origine de façon à protéger de la lumière.
Précautions particulières de conservation selon pertinence
Les pénicillines et les céphalosporines peuvent provoquer une hypersensibilité (allergie) à la suite de leur injection, inhalation, ingestion ou au contact de la peau. L’hypersensibilité aux pénicillines peut conduire à des réactions croisées avec les céphalosporines et réciproquement. Les réactions allergiques à ces substances peuvent parfois être graves.
Ne pas manipuler le produit en cas d’hypersensibilité connue ou s’il vous a été recommandé de ne pas travailler avec de telles préparations.
Manipulez le produit avec soin, en prenant les précautions conseillées pour éviter toute exposition.
Si, à la suite d’une exposition, vous développez des symptômes comme un érythème cutané, consultez un médecin. Un œdème du visage, des lèvres, des yeux ou une difficulté respiratoire, sont des symptômes plus graves qui nécessitent une consultation médicale d’urgence.
Si vous êtes allergique aux pénicillines ou aux céphalosporines, évitez tout contact avec les litières contaminées.
En cas de contact, laver la peau avec de l’eau et du savon.
Précautions particulières à prendre lors de l'élimination de médicaments non utilisés ou de déchets dérivés de l'utilisation de ces médicaments
Tous les médicaments vétérinaires non utilisés ou dérivés de ces médicaments doivent être éliminés conformément aux exigences locales.
Nature et composition du conditionnement primaire
Lyophilisat : Flacon en verre de Type I de 5 ou 23 ml avec un bouchon en caoutchouc fermé par une capsule aluminium. Diluant : Flacon en verre Type I de 10 ou 19 ml avec bouchon en caoutchouc fermé par une capsule aluminium. Présentation : 1 flacon de lyophilisat et 1 flacon de diluant. Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l'autorisation de mise sur le marché
Présentations commercialisées et AMM
| Présentation | GTIN | Numéro d'autorisation de mise sur le marché | Date de première mise sur le marché (ou AMM) | Classement du médicament en matière de délivrance | Accessible aux groupements |
|---|---|---|---|---|---|
| CONVENIA® Flacon 10ml - SOL INJ. POUDRE + SOLVANT | 5414736007786 | Flacon de 23 mL : EU/2/06/059/001 - 19/06/2006 - 15/06/2011<br />Flacon de 5 mL : EU/2/06/059/002 - 19/06/2006 - 15/06/2011 | 6/19/2006 | Non | |
| CONVENIA® Flacon 4ml - SOL INJ. POUDRE + SOLVANT | 5414736022574 | Flacon de 23 mL : EU/2/06/059/001 - 19/06/2006 - 15/06/2011<br />Flacon de 5 mL : EU/2/06/059/002 - 19/06/2006 - 15/06/2011 | Non |
